انواع پیوند های مواد
همه ترکیبات شیمیایی همه وا کنش های شیمیایی و هر چیزی که مربوط به شیمی باشد. در واقع اتصال چند مولکول با هم دیگر است. مولکول ها هم به طرق گوناگونی با هم پیوند میخورند. حالا میخواهیم چند نوع از این پیوند ها را بررسی کنیم.
این یک نمونه از پیوند شیمیایی است.
مواد به چه وسیله ای با هم پیوند میخورند؟
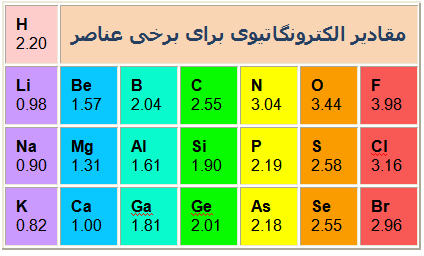
مهم ترین عامل برای پیوند دو مولکول الکترون های آن است. مواد یا دوست دارند الکترون بدهند یا بگیرند. و جدیدا یک معیاری برای الکترون خواهی آنها درست شده به نام الکترونگاتیوی. که هر چه این معیار بیش تر باشد اتم تمایل بیشتری به گرفتن الکترون دارند. و هر چه کمتر باشد تمایل بیشتری به از دست دادن آن دارند.در جدول تناوبی هر چه به سمت هالوژن ها میرویم الکترونگاتیویته بیشتر میشود. این هم یک نمودار.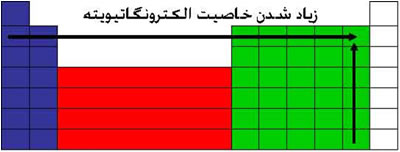
و در صدر جدول فلوِئور را میبینیم. که دزد الکترون به حساب می آید.و در عوض فلزات قلیایی عاشق دادن الکترون هستند.
ولی در این جدول ها گازهای نجیب به شمار نمیروند چون واکنش های بسیار کمی دارند. و نه علاقه به دادن الکترون و نه علاقه به گرفتن آن دارند.
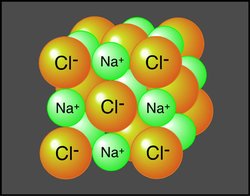
اکنون برایتان یک مثال از یک پیوند شیمیایی ساده میزنم . این پیوند همان پیوند نمک است.این پیوند یک پیوند یونی است. که در آن سدیم که دوست دارد الکترون بدهد الکترون هایش را به کلر میدهد. و سدیم به حالت مثبت در میاید و کلر به صورت منفی و به دلیل اختلاف بار به هم میچسبند. و همینطور ادامه پیدا میکند تا یک شبکه بلورین به وجود بیاید.
انواع پیوند ها:
1.یونی:
این پیوند یکی از پر کاربرد ترین پیوند های مواد است.این پیوند همیشه بین یک فلز و نا فلز اتفاق می افتد.و به تولیدات آن نمک میگویند. که نمک طعام(nacl)یکی از آن ها میباشد. حالا مکانیزم این پیوند را بررسی میکنیم.
این پیوند در صورتی به وجود می آید که یک ماده تمایل به دادن الکترون و ماده ای دیگر تمایل زیادی به گرفتن الکترون داشته باشد. و این دو ماده الکترون هایشان را با هم جا به جا میکنند. و یکی به دلیل کمبود الکترون به صورت یون مثبت و دیگری به دلیل زیاد بودت تعداد الکترون هایش به صورت یون منفی درمی آید.و این دو مولکول به دلیل اختلاف پتانسیل بارسان به یکدیگر میچسبند. مثل نمک که مثالش در بالا زده شد. این دسته ترکیبات استفاده زیادی در صنعت دارند.
2.پیوند های کوالانسی
این پیوند ها دومین دسته از پیوند های مهم اند و بین دو یا چند اتم تشکیل میشود که الکترونگاتیویته آنها خیلی با هم تفاوت نداشته باشد. در این پیوند ها نیاز به این احساس میشود که الکترون ها به جای جا به جایی اشتراک گذاری شوند.مکانیزم این پیوند به این صورت است که الکترون بین دو یا چند مولکول اشتراک گذاری میشود.و بین آنها میچرخد.
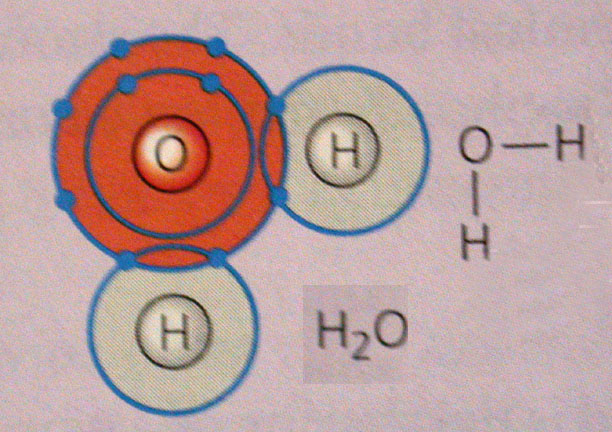
مثال بارز این پیوند هم همین آب(H2O)است. در آب الکترون هیدروژن ها بین دیگر مولکول هیدروژن و اکسیژن وسط میچرخد.
و پیوند های فلزی نیز هم از همین نوع هستند. و لایه های آخر الکترون های آنها به خوبی همدیگر را همپوشانی میکنند. و این پیوند بسیار محکمی است.
اگر این مطلب به دردتان خورد نظر بدهید.






در ضمن ما یه جور هایی با هم همکار هستیم
لطفاوب ما رو نیز لینک فرمایید
با نام فیزیک برای زندگی
http://physics1.blog.ir